POLYMERES
Plan
général de cette étude:
A) Polymérisation par addition ou par condensation:
B) Propriétés générales des substances obtenues:
C) Polymérisations par addition:
D) Polymérisations par condensation:
E) Macromolécules naturelles:
F) Substances macromoléculaires artificielles,dérivées de
macromolécules naturelles:
G) Des abréviations:
H) Planches sur les matériaux polymères :
Plan
détaillé:
A) Polymérisation par addition ou par condensation:
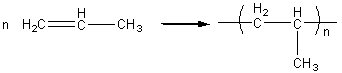
Polymérisation par addition
Réaction
d’addition d’un grand nombre de molécules identiques pour donner un composé à
masse molaire élevée.
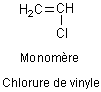
Ex: poly(chlorure de vinyle)
Conduit à
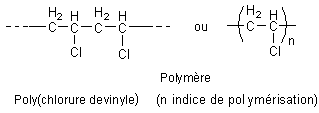
La
partie entre parenthèses dans la formule est le motif du polymère.
S’il
y a 2 monomères (très exceptionnellement 3), c’est une copolymérisation:
Exemple :
CH2=CH2
éthylène
et
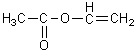
acétate de vinyle
conduisent
à
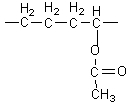
polyéthylène vinylacétate (films étirables).
Polymérisation par condensation
Réaction
entre 2 molécules, avec élimination d’une petite molécule (H2O,
HCl,....) qui se répète un grand nombre de fois pour donner un composé de masse
molaire élevée.
Ex: nylon
HOOC-(CH2)4-COOH acide adipique et H2N-(CH2)6-NH2 hexaméthylène
diamine donnent ....-[OC-(CH2)4-CO-NH-(CH2)6-NH]-CO-(CH2)4-CO-NH-(CH2)6-NH-.....
Le motif est entre crochets.
Dans une polymérisation par addition, il y a addition grâce à des
liaisons multiples (composés insaturés) ; Dans une polycondensation, il y a réaction entre 2 groupements
fonctionnels (ou 2 atomes) : OH, NH2, -COOH,
Cl .
N.B: Les
substances obtenues portent le nom de polymères. Ce sont des substances macromoléculaires.
B) Propriétés générales des substances obtenues:
- substances transparentes, translucides, ou blanches.
Remarque:
appellation résine, pour certaines d’entre elles, à
cause de leur aspect, mais on peut leur incorporer :
des colorants ( au sens strict : teinture par réaction
chimique avec le polymére : azoïques, anthraquinoniques,........Pigments :
solides en dispersion, oxydes minéraux, phtalocyanines,.....)
des plastifiants (pour assouplir certaines
matières dures) : acétates amyliques (les alcools amyliques sont en C5) ;
phtalates amyliques ; " polybenzyle " ; phosphate de triphényle.
des charges (pour améliorer les propriétés physiques et
mécaniques et électriques, on disperse des solides: craie, alumine, noir de
carbone, ....)
des stabilisants : résistance à l’environnement (anti-oxydants
: on les trouve surtout dans les caoutchoucs (C=C) mais aussi dans le
polyéthylène,.... ex: phénols, amines,....noir de carbone, complexants d’ions
métalliques. Anti-UV,.... souvent C=O conjugué à un cycle benzénique,
mais aussi certains pigments colorés : TiO2, noir de carbone,...)
des
ignifugeants : composés organiques chlorés, phosphates, borates.
des
antistatiques: contre l’accumulation d’électricité (NH4+ quaternaires,
esters de polyols, poudres métalliques....des fongicides : thiocarbamates,
NH4+ quaternaires...).
des odoriférants.
-Surface lisse
-
" légères ": la majorité a une densité comprise entre 1 et 1,6.
-
Inaltérables par de nombreux agents chimiques
-
Ce sont souvent de bons isolants électriques.
-
Elles se prêtent facilement à des opérations telles que :
moulage
calandrage (= laminage,cylindres chauffés)
filage et tissage
extrusion (analogue au filage mais avec une filière
plus compliquée qu’un trou circulaire; on obtient des profilés ex : tuyau)
soudage par pression, à chaud.
-
Quelques unes peuvent être expansées, c’est à dire acquérir une structure
alvéolaire, qui en font d’excellents isolants thermiques et qui sont utilisées
aussi pour la protection contre les chocs.
Pour
obtenir le produit expansé on fait la polymérisation dans un solvant très
volatil (son départ à l’état gazeux provoque les alvéoles) ou bien on superpose
à la polymérisation une réaction chimique qui produit un dégagement gazeux CO2,
N2).
-
Enfin, certaines, par leur consistance ou mises en solutions dans des solvants
appropriés peuvent être le constituant principal de colles, peintures ou
vernis.
Ce sont des matières plastiques:
On
peut donner comme définition des matières plastiques: ce sont des matériaux
artificiels qui, au moins au moment de leur mise en oeuvre, sont suffisamment modelables
sous l’effet de contraintes extérieures (température, pression,....)
relativement faibles, pour être mis en forme avant de se solidifier.
On
distingue:
a) les
thermoplastiques, déformables à chaud ; se solidifient au refroidissement
en conservant la forme qui leur a été imposée ; la déformation ultérieure est
possible sous l’influence d’une force ou d’une élévation de température. La
plasticité à chaud correspond à l’existence de macromolécules linéaires. Lors
de la formation, les molécules s’accrochent pour donner un composé n’ayant plus aucune
fonction pour réagir avec les molécules voisines : ex : polyéthylène CH2-CH2-CH2-CH2-
b) les
thermodurcissables: La mise en forme se fait à chaud par pulvérisation dans
un moule et c’est alors que les liaisons avec les molécules voisines
s’établissent. La matière se durcit et toute modification ultérieure devient
impossible. La rigidité à chaud correspond à un édifice tridimensionnel dans
lequel les chaînes sont enchevêtrées.
Ex
: résine glycérophtalique (polycondensation glycérol + acide o.phtalique)
Les
thermodurcissables ne sont donc plus plastiques dès l’instant où ils sont
constitués. Mais l’addition de plastifiant supprime leur rigidité. D’une façon
générale la plasticité peut être augmentée par adjonction de plastifiant; ex :
le PVC dur et cassant (canalisations pour l’eau, le téléphone,....) par
adjonction de plastifiant, devient souple (tuyau d’arrosage).
Les
plastifiants agissent:
*
dans les thermoplastiques, par simple insertion.
*
dans les thermodurcissables, en écartant les groupements fonctionnels
susceptibles de provoquer des liaisons en différents points des chaînes. Dans
les deux cas, les forces de cohésion entre les chaînes sont diminuées ce qui
explique la souplesse de l’édifice.
C) Polymérisations par addition:
MECANISME GENERAL DE CES POLYMERISATIONS:
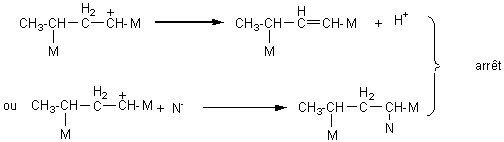
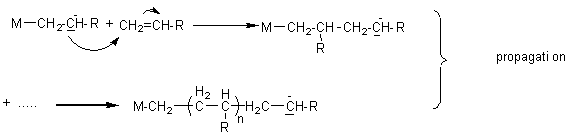
Ce
sont des réactions en chaîne qui comportent plusieurs étapes:
- initiation
- propagation
- arrêt
Il
y a plusieurs types de mécanisme:
**radicalaire :
L'initiation
nécessite un radical A. que l'on obtient grâce à un initiateur (par exemple le peroxyde de benzoyle):
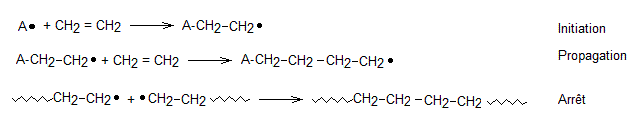
** cationique :
L'initiation
nécessite soit un acide fort (acide sulfurique) ou un acide de Lewis en
présence d'eau. C'est H+ qui se forme:
![]()
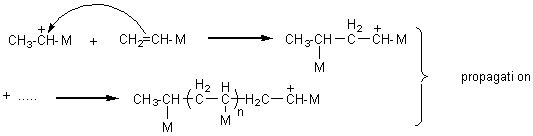
** anionique :
L'initiation
nécessite une base : ion hydroxyde (HO-),
ion alcoolate (RO-), ion amidure (NH2-): on le
désignera par M-:
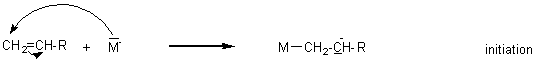

I)Polyoléfines:
1) Polyéthylène :
Inertie chimique remarquable (structure d’alcane); application:
flacons
Facilité
de mise en forme: feuilles d’emballage, cuvettes moulées
Excellent
isolant électrique; application: gaines pour lignes électriques.
En
fait il existe deux variétés:
polyéthylène
" ;basse densité ;", souple, à chaînes ramifiées, dit
haute pression(1000 atm, 200°C)
polyéthylène "
;haute densité ;", dur, peu ramifié, dit basse pression (10 atm, 100°C)
2) Polypropylène (= polypropène)
Ressemble au polyéthylène haute densité; tissu (Méraklon), cuves d’accumulateurs, rubans pour cercler les colis.
3) Téflon:
C’est le polytétrafluoroéthylène (PTFE)
Résistance
chimique remarquable; peut supporter 200°C! Anti-adhérent.
Applications:
- Revêtement de
poêle à frire, de cuves de réacteurs dans l’industrie chimique.
- En chirurgie,
clips vasculaires ; utilisé aussi en orthopédie.
- On peut aussi
citer un tissu à base de PTFE, le Gore-Tex® :
Bill et Bob GORE
père et fils chimistes américains.
Bob en colère a étiré violemment du téflon
(polytétrafluoroéthylène PTFE) chaud et par hasard a obtenu la fibre textile
Gore-Tex®. (Brevet 1969)
La membrane imperméable est
"respirante" ! C’est là que réside le principal progrès par
rapport aux tissus synthétiques étanches.
Des définitions
:
-
Imperméable : étanche aux liquides, mais laisse filtrer l’air et la vapeur
d’eau plus particulièrement celle produite par les mouvements du corps. On
parle alors de « respirabilité ».
-
Etanche : la membrane ne laisse pas passer la vapeur d’eau produite par
les mouvements du corps ; cette vapeur d’eau vient se condenser au niveau
de la membrane et l’humidité reste au contact du corps.
La technologie de la membrane Gore-Tex®:
La membrane de téflon étiré comporte une multitude
de très petits pores.
Un milliard quatre cents millions de pores au
centimètre carré d’un diamètre de 0,2 micromètre. Selon les techniques de mise
en œuvre le nombre et la dimension des pores sont variables.
Les pores sont 20000 fois plus petits qu’une goutte
d’eau ; mais 700 fois plus grands qu’une molécule d’eau à l’état gazeux.
Cette structure microporeuse permet de laisser
passer la vapeur d’eau produite par le corps d’où la
« respirabilité » mais d’arrêter l’eau à l’état liquide venant de
l’extérieur d’où l’imperméabilité. La dimension des pores permet de favoriser
la « respirabilité » ou l’imperméabilité.
On mesure l’imperméabilité d’un tissu en Schmerber,
cela correspond à la pression à partir de laquelle le tissu se laisse traverser
par l’eau. L’ordre de grandeur de l’imperméabilité d’une membrane Gore-Tex® est
1500 Schmerber
1Schmerber =1 mm de colonne d’eau= 10 Pa=0,1mbar
On mesure la « respirabilité » d’un tissu
donc sa capacité à évacuer la vapeur d’eau
par son indice RET. (Resistance Evaporative Transfert)
Plus l’indice est faible plus le vêtement est
respirant, un vêtement d'indice inférieur à 12 est respirant, au-delà de 20 il
est non respirant. L'indice RET du Gore-Tex® varie entre 2,5 et 6 RET.
II)Caoutchoucs artificiels :
Les élastomères : Ce
sont des substances qui sous l'effet de la traction subissent un allongement
important (seules sont intéressantes celles dont les dimensions peuvent
tripler) qui cesse quand l'action mécanique cesse.
Le
caoutchouc naturel extrait du latex de l'hévéa est le polyisoprène, l’isoprène
étant le 2-méthylbutadiène
![]()
Le
motif du caoutchouc naturel :
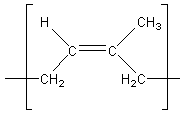
correspond
à un enchaînement (Z)1,4 de l'isoprène.
La
polymérisation du 2-méthylbutadiène peut aussi se faire par enchaînement (Z)
1,4 en utilisant du lithium métal finement divisé ou des catalyseurs de type
Ziegler (tétrachlorure de titane et trialkylaluminium).
Le
(E) 1,4-polyisoprène appelé gutta-percha a des propriétés différentes du
caoutchouc naturel (plus dur et cassant). Contrairement à celui-ci qui a une
structure amorphe, le gutta-percha, du fait de son enchaînement (E), a une
structure semi-cristalline.
1) A partir du butadiène :
* copolymérisation avec le styrène :
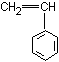
donne
le SBR (Styrène Butadiène Rubber) utilisé pour la fabrication des pneus de
tourisme.
*
copolymérisé avec l’acrylonitrile :
![]()
donne
le caoutchouc nitrile particulièrement résistant à l’essence et à l’huile
(application: tuyaux d’essence).
* seul, le polybutadiène n’est pas très intéressant, mais mélangé à du caoutchouc naturel, à du polyisoprène de synthèse ou à du SBR, il sert à faire des pneus très résistants pour gros engins.
2) A partir de l’isobutène :
copolymérisé avec quelques % d’isoprène donne le Butyl, particulièrement imperméable aux gaz; application: chambres à air.
3) A partir du chloroprène :
On obtient le Néoprène....
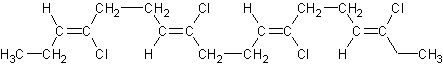
résistant aux frottements, au soleil,aux solvants; ne propage pas
la flamme.
Application: gaines
électriques,courroies,combinaisons de plongée, pâtes élastiques pour
l’étanchéïté, colle (colle au néoprène).
III) Polymères vinyliques :
Le groupement vinylique est CH2=CH-
1) Polychlorure de vinyle : (ou chlorure de polyvinyle ou PVC)
Le chlorure de vinyle est un gaz qui se
polymérise spontanément
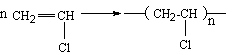
Rigide mais facile à plastifier, ses
applications sont nombreuses:
on utilise surtout son aptitude à donner des
profilés : fils (tissu Rhovyl), tuyaux pour l’écoulement des eaux, bouteilles
(eaux minérales).Utilisé aussi en médecine (poches de sang, cathéters).
C’est un bon isolant électrique (gaines de
fils électriques) ; on l’utilise aussi pour des revêtements de sol (gerflex),
pour imiter le cuir (skaï), en peinture (peinture vinylique).
2) Polyacétate de vinyle :
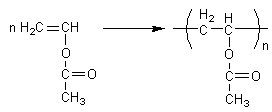
Colle.
L’hydrolyse du polyacétate de vinyle fournit
le polyalcool vinylique
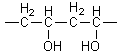
intermédiaire dans la fabrication
d’autres matières plastiques : les polyacétals.
NB:
1) l’alcool vinylique CH2=CH-OH
n’existe pas
2)les polyacétals sont parfois
classés dans les composés vinyliques, mais il y a polycondensation
et non polyaddition.
IV) Polymères styréniques :
1) Polystyrène : ou PS
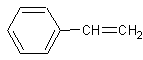
encore appelé styrène. Sa polymérisation
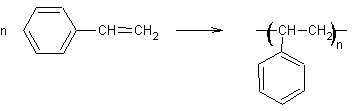
Il se prête très bien au moulage ; on en fait
de nombreux objets moulés, généralement blancs (pots de yaourt).
Il se prête bien à l’expansion, on obtient le polystyrène expansé, aux qualités isolantes (thermiques) remarquables (glacières portatives) et est très utilisé également pour la protection contre les chocs (emballage d’appareils fragiles).
Remarque : On expanse les polymères par dégagement d'un gaz au sein
de la matière, ce qui forme des bulles ou cellules :
* par vaporisation d'un liquide dissous( par exemple du
pentane dissous dans le polystyrène et dégagé par chauffage).
* par injection d'un gaz inerte au sein d'un polymère
fondu, par exemple dans une extrudeuse (mousse de polyéthylène).
* par décomposition d'un composé chimique dispersé dans
la masse, comme l'hydrogénocarbonate de sodium qui en se décomposant par la
chaleur donne des bulles de CO2 (principe de la levure chimique dans
un gâteau).
* par réaction chimique comme celle d'un isocyanate sur
l'eau dans la fabrication de certains polyuréthanes :
2 R-N=C=O + H2O = R-NH-CO-NH-R + CO2
On trouve dans le commerce :
- le PS "cristal"
qui est un homopolymère amorphe, dur et cassant. Il est thermoplastique ce qui
est un avantage et transparent (boîtes,
corps de stylos à bille, pipettes incassables).
- le PS "choc" qui
est constitué d'une phase polystyrène dans laquelle sont noyés des nodules de
polybutadiène qui sont capables d'absorber une partie de l'énergie d'un choc
éventuel. On l'utilise pour fabriquer le corps de certains appareils
électroménagers.
2) Poly(styrène,acrylonitrile) : ou SAN
Transparent comme le polystyrène mais plus
résistant aux chocs.
V) Polymères acryliques :
Ce sont des polymères dérivant de l’acide acrylique CH2=CH-COOH
1) Polyméthacrylates :
- de
méthyle : ou
PMMA
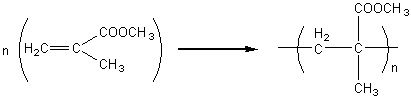
On obtient facilement un produit très
transparent.
C’est un verre organique (plexiglas); pour
cette raison, on l’utilise en optique (verre de lunettes, lentilles de contact
rigides, cristallins artificiels).
Certains composés polymères à base de
méthacrylate de méthyle sont utilisés comme ciments acryliques pour orthopédie
et odontologie, pour des prothèses faciales, pour le comblement de pertes de
tissus osseux et de tissus poreux.
- de 2-hydroxyéthyle
:
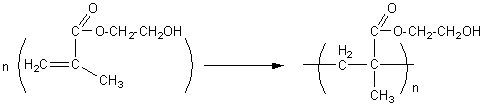
lentilles de contact souples , chirurgie
plastique, surfaces antithrombogènes.
2) Polyacrylates :
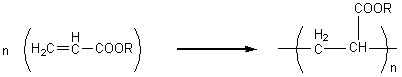
Application : peinture acrylique
Le polyacrylate de sodium :
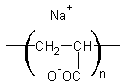
absorbe 800 fois sa masse en eau
distillée, 300 fois sa masse en eau du robinet et 60 fois sa masse en sérum
physiologique (0,9% NaCl).
Il est utilisé comme absorbant dans
les couches jetables qui en contiennent environ 15g (soit un pouvoir absorbant
de 900g d'urine environ).
Le polyacrylate de sodium enserre
les molécules d'eau qui sont retenues par attraction électrostatique comme
indiqué ci-dessous et forme un gel :
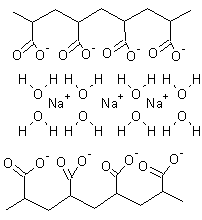
3) Polyacrylonitrile
: ou PAN
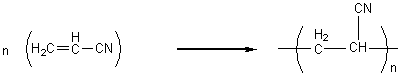
Applications :
fibres textile (Crylor...).
Elles sont fabriquées à partir de
polyacrylonitrile PAN (appelé précurseur) .
Les utilisations sont nombreuses : raquettes
de tennis, cannes à pêche, bâtons de ski, clubs de golf, vélos, pales
d'éoliennes, renforcement du béton, pièces d'avions (freins, empennages,
volets), pièces de voitures (freins de voitures de formule 1) ; on l'utilise en
chirurgie (prothèse de hanche par exemple)....
4) Poly(acrylonitrile, Butadiène, Styrène) : ou ABS
Utilisé dans l’industrie automobile (calandre, tableau de bord), dans l’équipement ménager (corps d’aspirateurs), pour faire des jeux de construction (Lego).
D) Polymérisations par condensation :
I) Polyamides :
Caractérisés par la répétition du
groupement peptidique -CO-NH- qui résulte de la condensation, d’un acide
carboxylique et d’une amine:
-COOH + H2N ![]() -CO-NH-
+ H2O
-CO-NH-
+ H2O
1) Nylon :
HOOC-(CH2)4-COOH
acide adipique
H2N-(CH2)6-NH2
hexaméthylènediamine
condensés à 270°C et 10 atm donnent un
polymère : -(HN-(CH2)6-NH-OC-(CH2)4-CO)n-
dont le motif est : - HN-(CH2)6-NH-OC-(CH2)4-CO-
Cette structure rappelle celle de la kératine
des poils (laine) et celle de la fibroïne de la soie. On peut faire des fils de
nylon remarquablement tenaces (~ acier), résistants à l’usure, au froissement
et qui prennent la teinture----> tissus; on les utilise également en
chirurgie (sutures).
La résistance au frottement et au choc permet
d’en faire des pièces mécaniques (engrenages).
NB: ce nylon est le polyamide 6-6
(amine à 6C et acide à 6C); le mot " nylon " qui est une marque,
remplace souvent polyamide.On fabrique couramment un autre nylon, le polyamide
6 dont le motif est -NH-(CH2)5-CO-
2) Rilsan :
à partir de H2N-(CH2)10-COOH
acide undécanoïque, provenant de l’huile de ricin, on fabrique un tissu.
3) Polyaramides :
Couramment appelés "aramides" ; ce sont des polyamides comportant des noyaux
aromatiques.
L’aramide le plus connu est
le kévlar obtenu en
1973 en condensant HOOC-C6H4-COOH
(les 2 COOH en para : acide téréphtalique) et H2N-C6H4-NH2 (les 2 NH2
en para : p.phénylènediamine) on obtient -OC-C6H4-CO-HN-C6H4-NH-
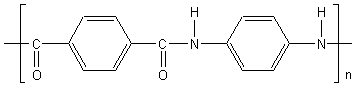
Sa résistance mécanique et à la chaleur est
supérieure à celle du nylon ; c'est aussi un très bon isolant électrique On en
fait des amarres de navires, des gilets pare-balles…..
Les aramides comme le Kévlar sont des
para-aramides.
On connaît aussi des méta-
aramides (par exemple : acide adipique HOOC-(CH2)4-COOH
et m-xylènediamine NH2-CH2-C6H4-CH2-NH2
en méta pour les deux groupements).
On obtient:
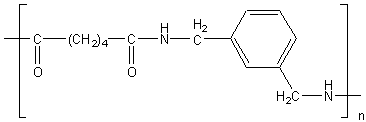
Elles constituent des fibres textiles légères et résistantes.
II) Polyesters :
Ils comportent la répétition de la fonction ester.
1) Polytéréphtalate d’éthylène glycol : ou PET
L' acide téréphtalique et le
glycol conduisent à un polymère, le poly(téréphtalate d'éthylène glycol).
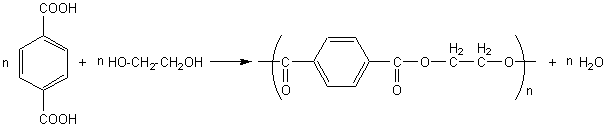
textile (Tergal) ; ruban support
d’enregistrement audio et vidéo(cassettes), feuilles d’emballage conservant
l’arôme (café), bouteilles de boissons gazeuses.En chirurgie: prothèses
vasculaires et valves cardiaques.
2) Résines glycérophtaliques : peintures,vernis
Ex: acide orthophtalique HOOC-C6H4-COOH
(les 2 COOH en ortho) et glycérol HO-CH2-CHOH-CH2-OH
donnent: -OC-C6H4-COO-CH2-CH(OCO-C6H4-CO-)-CH2-O-
Ce sont des polymères tridimensionnels.
3) Polyesters insaturés :
Ex: HOOC-CH=CH-COOH (acide maléique) avec
HOOC-C6H4-COOH (acide
o.phtalique) et HOCH2-CH2OH (glycol)
donnent: OC-CH=CH-CO-O-OC-C6H4-CO-OCH2-CH2O-
polymaléophtalate d’éthylèneglycol.Le plus
souvent on leur incorpore de la fibre de verre.
Application: éléments de carrosserie,coque de bateaux.
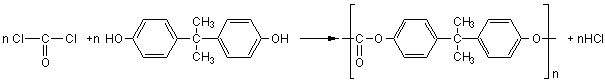
III) Polycarbonates
: ou PC
Le chlorure de carbonyle (COCl2) avec un
diphénol (le bisphénol
A)conduit à un polymère transparent, résistant aux chocs.
Applications: panneaux de balcons, luminaires:
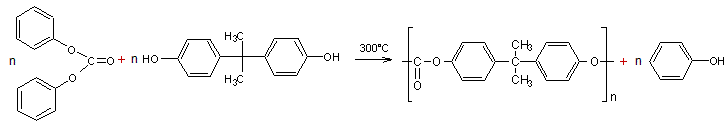
Ce même polymère (le
poly(carbonate de bisphénol A)) peut aussi s'obtenir en faisant réagir le
bisphénol A sur le carbonate de diphényle selon l'équation :
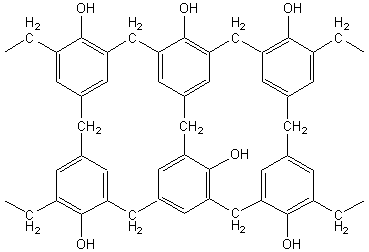
IV) Phénoplastes :
Ils résultent de la polycondensation d’un phénol et d’un aldéhyde.
Leur élaboration comporte
trois stades A, B, C. Ils sont
fluides dans l'état A, pâteux à chaud dans l'état B, durs et infusibles dans
l'état C après que les résines aient été mélangées à des charges (poudre de
bois) à des plastifiants et des pigments puis aient été chauffées et
comprimées.
Exemple : résine Benzophénol-Formol
(méthanal) = bakélite (ce nom vient de son inventeur : L.H.Baekeland
1863-1944, chimiste belge puis américain).
On obtient des matières dures (plastiques
thermodurcissables), de couleur sombre, à propriétés isolantes avec lesquelles
on fait des objets moulés (queues de casseroles), des supports de circuits
imprimés, des résines échangeuses de cations (type phénoplaste sulfoné).
Globalement on peut considérer qu'il s'agit
d'une élimination d'eau entre deux cycles benzéniques et une molécule
d'aldéhyde; l'existence de trois endroits réactifs sur la molécule de phénol
(en ortho et en para par rapport au OH) permet la formation d'un réseau
complexe tridimensionnel (résine) dont la représentation ci-dessus n'est que
partielle.
Le mécanisme implique tout d'abord, la
formation d'un alcool hydroxybenzylique:
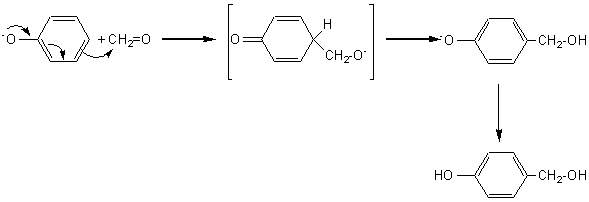
La seconde étape est la condensation de cet
alcool avec une molécule de phénol, en para ou en ortho du OH phénolique:
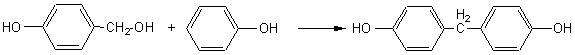
par le mécanisme suivant:
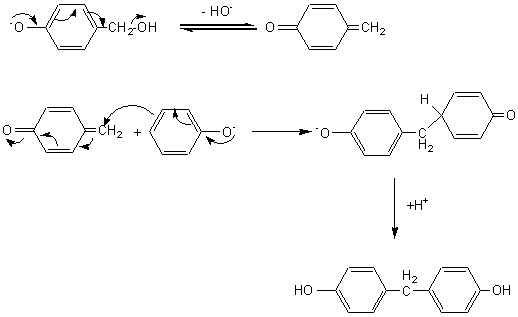
et ainsi de suite...
V)Aminoplastes :
Ils résultent de la
polycondensation du méthanal (formol) H2C=O avec
des composés à groupement -NH2. Mêmes propriétés que les phénoplastes mais teintes très claires,
faciles à colorer.
Remarque : à l’origine on a fabriqué la galalithe
(boutons), par action du formol sur la caséine du lait
(la caséine comporte des fonctions amine)
1) Résine urée-formol :
l’urée a pour formule CO(NH2)2 ;
condensée avec le méthanal on obtient en première étape:
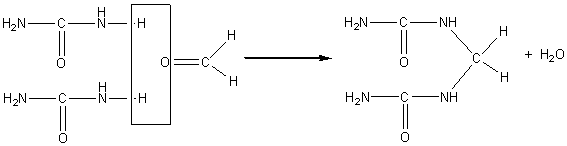
puis progressivement un réseau
tridimensionnel serré :
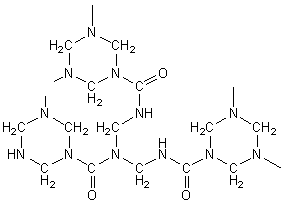
Applications : colle à bois, panneaux de particules agglomérées.
2) Résine mélamine-formol :
L’amine est la mélamine.
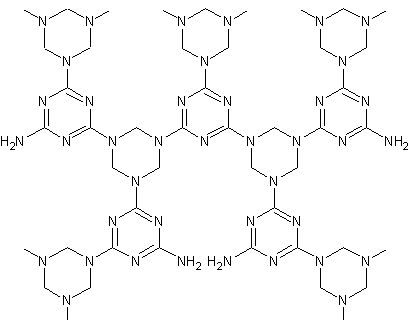
Applications: revêtements stratifiés (formica), résines échangeuses d’anions
(type hydroxyde d’ammonium quaternaire), colles avec durcisseur.
VI) Polyéthers :
-R-O-R-O-
Résultent de la polycondensation de diols ou
de la polymérisations d’aldéhydes.
Exemple: le polyoxyméthylène -CH2-O-CH2-O-
Auto-lubrifiant, atténue les bruits.
Application: galets anti-bruit. Résistant au dépôt de microorganismes.
Application: hachoirs à viandes, raccords d’adoucisseurs d’eau.
VII)
Polymères époxydes : ou PE
Résines dont l’obtention est
basée sur la chimie des époxydes.
Rappelons qu'un époxyde (ou oxirane) est une
molécule contenant un "pont oxygène" entre deux carbones adjacents
d'une molécule :
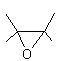
La première étape est la
formation d'un prépolymère par condensation polymérisation du sel de sodium du
bisphénol A avec l'épichlorhydrine :
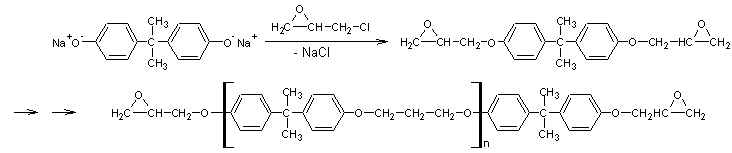
Le degré de polymérisation de ce prépolymère est faible (n compris entre 5 et
12 unités).
La résine (polymère
tridimensionnel) s'obtient ensuite par réaction des oxiranes avec une triamine
comme par exemple la diéthylène triamine (NH2-CH2-CH2-NH-CH2-CH2-NH2).
La réticulation se fait de la
manière suivante :

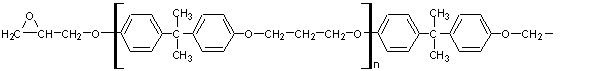
L’appellation " polyépoxyde
" n’est pas heureuse, car il n’y a pas répétition d’un motif issu
d’époxyde seulement. L’appellation " époxyde " entraîne la confusion
avec l’un des monomères.
Applications : revêtement intérieur de boîtes de conserves.
On peut aussi utiliser cette synthèse en deux
parties pour réaliser des colles aux propriétés adhésives remarquables :
la colle "époxyde" ,
VIII) Polyacétals : POM
Un acétal :
Les
polyacétals sont des acétals de polyvinylalcool et d’aldéhydes; les aldéhydes
utilisés sont l’aldéhyde formique (méthanal), l’aldéhyde acétique (éthanal),
l’aldéhyde butyrique (butanal).
Ex: polyvinylbutyral
Il est transparent et adhère très bien au verre. Application: pare-brise
feuilleté.
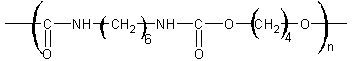
IX) Polyuréthanes :
Résultent de l’action d’un di-isocyanate sur un diol
![]()
Remarque : c’est une polycondensation sans élimination. On fabrique
couramment le polyuréthane pour lequel R est C6H5-CH3
et p = 4 ; le 4,4'-diphénylméthane
diisocyanate (ou 4,4'-MDI) est aussi très utilisé.
Applications : En médecine : cathéters, pompes cardiaques ; sous la forme
expansée : matelas mousse.
Une application très connue est l'élasthanne ® :
Mis au point par le
scientifique Joseph C. Shivers de la firme américaine
DuPont dans les années 1960 l'élasthanne a été un évènement dans l'industrie
textile. Thermoplastique, très élastique, cette fibre a été introduite d'abord dans
les vêtements de sport (maillots, justaucorps, collants….), puis dans
l'ensemble des vêtements dès les années 1980.
La surface des vêtements en
élasthanne est très lisse et résiste au développement des champignons ; cette
fibre ne perd pas son élasticité aux basses températures et n'entraîne pas
d'allergie contrairement au latex.
Elle se teint très facilement.
X) Polyimides :
Ces matières plastiques
relativement récentes ont la propriété de résister au frottement et à
l’échauffement (400°C) pendant un temps très long.
Applications: pièces d’amortisseur de wagons, supports des connexions de
circuits électroniques (échauffement lors de soudures).
XI) Silicones :
Le Silicium, tétravalent comme C,
peut remplacer celui-ci dans la constitution d’édifices organiques; il existe,
en particulier, des silane-diols R1(R2)Si(OH)OH.
Les silicones ont une grande inertie chimique.
Ils résistent bien au froid et à la chaleur; ils diffèrent, en cela, de la
plupart des autres matières plastiques. Ils sont hydrofuges. Liquides, ils
servent à enduire tissus, papier, ....... pour les rendre non
mouillables.Visqueux, ils servent au graissage (graisse à rodages Rhodorsil).
Les caoutchoucs aux silicones restent
élastiques entre -80°C et +320°C; on en équipe des avions de haute altitude.
En médecine, les silicones sont utilisés pour
les tubes, oxygénateurs et en chirurgie plastique.
E) Macromolécules naturelles:
I)Cellulose:
Résulte de la polycondensation de
glucose (C6H12O6)
CH2OH-CHOH-CHOH-CHOH-CHOH-C(H)=O
Cette molécule peut prendre une forme
cyclique:
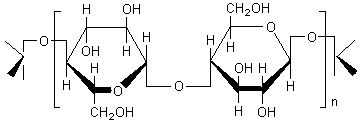
Les différentes chaînes linéaires placées
côte à côte sont liées par de nombreuses liaisons hydrogène ce qui donne à ce
matériau une très grande rigidité et qui explique qu'elle est la substance de
soutien (parois) des cellules jeunes des végétaux.
La cellulose pratiquement pure est tirée du
fruit du cotonnier; il contient des graines recouvertes d’un duvet formé de
fibres de 2 à 7 cm de long; débarrassées des impuretés, ces fibres constituent
le coton hydrophile.
La cellulose s’obtient également à partir du bois; le bois
est essentiellement constitué de cellulose et de lignine; un traitement à
l’hydrogénosulfite de calcium détruit la lignine; il reste la pâte de bois; on
en fait le papier, le carton, ....
Elle n'est pas attaquable par les sucs
digestifs de l'homme. C'est une matière première de tout premier ordre dans
l'industrie chimique.
Elle est insoluble dans l'eau et la plupart
des solvants organiques et n'est solubilisée que par une solution ammoniacale
d'hydroxyde de cuivre(II): la liqueur de Schweitzer. Son hydrolyse acide
conduit au glucose.
II) Caoutchouc naturel :
Provient de la coagulation du suc
laiteux (latex) de l’hévéa; la coagulation s’obtient par action de l'acide
éthanoïque CH3COOH. C’est le polymère de l’isoprène (2-méthylbutadiène):
![]()
qui donne un polymère dont le motif est :

Il correspond à un enchaînement (Z)1,4 de l'isoprène.
A l’état pur, c’est un solide blanc, un peu
moins dense que l’eau, soluble dans le benzène (C6H6), le
tétrachlorométhane (CCl4 ).
Il se soude à lui-même, à froid, par simple
pression (pour 5<t<35°C). A t<5°C, il est cassant; à t> 35°C, il se
ramollit. Pour lui conserver son élasticité à froid et à chaud, on lui
incorpore environ 3% de soufre et diverses charges (magnésie,craie,....); on
obtient alors ducaoutchouc vulcanisé.
En incorporant davantage de soufre (30%), on
obtient un produit dur et cassant: l’ébonite. C’est un bon
isolant électrique.
III) Protéines :
Résultent de la polycondensation
d’un grand nombre d’acides a-aminés:
acides α-aminés : R-CH(NH2)-COOH
Ex: CH3-CH(NH2)-COOH alanine
NH2-CH(R1)-COOH +
NH2-CH(R2)-COOH ---> -NH-CH(R1)-CO-NH-CH-(R2)-CO-NH-CH(R3)-CO-
Les acides
a-aminés et les protéines sont des
constituants essentiels de la matière vivante. La chair des animaux est
essentiellement constituée de protéines. L’albumine des oeufs, les globulines
du plasma, la kératine des poils, etc.... sont des protéines. La nature, le
nombre et l’ordre d’enchaînement des divers acides aminés obéissent à des lois
rigoureuses pour former chaque protéine.
F) Substances macromoléculaires artificielles,dérivées de macromolécules naturelles:
Il s’agit pratiquement de substances dérivées de la cellulose (C6H10O5)n avec n = plusieurs milliers.
I) Viscose:
Cellulose avec
NaOH concentré -------> alcali-cellulose qui, avec CS2 ---->
xanthate de cellulose.
Le xanthate de cellulose se dissout dans la
soude en donnant un liquide sirupeux, la viscose, qui se coagule au contact des
acides en donnant une substance transparente et brillante. On obtient ainsi les
feuilles de cellophane et les fils de rayonne. Les tissus de rayonne
ressemblent à ceux en soie.
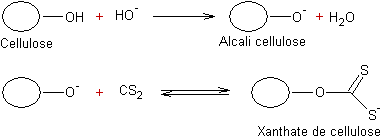
II) Nitrate de cellulose :
HNO3 peut
estérifier les -OH de la cellulose
-----------> " nitrocelluloses "
Le nitrate de cellulose à 12% d’azote (2 NO2 par
motif - attaque des OH secondaires) dissous dans un mélange alcool-éther, donne
un liquide sirupeux (collodion); ce produit, mélangé à du camphre en solution
dans l’alcool donne une pâte qui, après évaporation de l’alcool, devient le
celluloïd; utilisation: balles de ping-pong.
Une nitration plus poussée de la cellulose (~
13% d’azote) fournit le coton-poudre, explosif sans fumée.
Le coton, après traitement par le mélange
sulfo-nitrique, a à peu près l’aspect d’origine, mais il est plus rugueux; on
en fait une pâte par dissolution partielle dans un mélange alcool+éther; cette
pâte est ensuite filée, séchée et réduite en granulés. C’est le chimiste Christian Friedrich Schönbein qui
prépara le premier ce nitrate de cellulose en 1846.
III) Acétate de cellulose:
Une ou plusieurs molécules de CH3COOH
peuvent estérifier les -OH du motif de la cellulose.
La cellulose moyennement acétylée, soluble
dans l’acétone, peut donner une pâte qui, filée et séchée conduit aux fils
d’acétate; les tissus d’acétate ressemblent à la soie; avec l’acétate de
cellulose on fait encore les pellicules, support d’émulsions photographiques,
des montures de lunettes, des stylos, des manches d’outils, du vernis,.......
IV) Méthylcellulose, éthylcellulose, hydroxycellulose, carboxyméthylcellulose:
servent surtout à faire des colles, en particulier pour l’encollage des papiers peints
G) Des abréviations:
ABS
Terpolymère acrylonitrile-butadiène-styrène
CA Acétate de cellulose
CAB Acétobutyrate de
cellulose
EP Polyépoxydes
EVA Copolymère
éthylène-acétate de vinyle
MF Mélamine-formaldéhyde
NR Caoutchouc naturel
PA polyamides
6,6-6,6-10,11,12
PBT Polybutylène
téréphtalate
PC polycarbonates
PE Polyéthylène
PEBD
Polyéthylène basse densité
PEBDL
Polyéthylène basse densité linéaire
PEHD
Polyéthylène haute densité
PESU polyéthersulfone
PET Polyéthylène téréphtalate
PF Phénol-formaldéhyde
PI Polyimides
PMMA polyméthacrylate de
méthyle
POM Polyoxyméthylène
PP Polypropylène
PPO polyphénylène oxyde
PPS polyphénylène sulfure
PS Polystyrène standard
et choc
PSE Polystyrène expansible
PSU polysulfone
PTFCE
polytrifluorchloréthylène
PUR Polyuréthanes
PVACPolyacétate de vinyle
PVDC Polychlorure de
vinylidène
PVDF Polyfluorure de
vinylidène
PVC Polychlorure
de vinyle
SAN
Copolymère styrène-acrylonitrile
SI Silicones
UF Urée-formaldéhyde
UP Polyesters insaturés